EMERGENZA COVID - 19
In questo periodo viene privilegiata la TELEMEDICINA.
Per consultazioni in Videocall con il Prof. Giovanni M. Colpi, evitando viaggi e relative spese, inviare la richiesta a This email address is being protected from spambots. You need JavaScript enabled to view it., insieme con tutti gli esami finora eseguiti.
La Segreteria di Procrea provvederà a fissare l’appuntamento.
 Relazione* al XI. Eurasian Andrology Summit & 18th European Society of Sexual Medicine Joint Meeting, 4-6 February, 2016 - Madrid
Relazione* al XI. Eurasian Andrology Summit & 18th European Society of Sexual Medicine Joint Meeting, 4-6 February, 2016 - Madrid
Giovanni M. COLPI1, 2, Liborio VACCALLUZZO1, Elisabetta M. COLPI2
1ISES - Istituto per la Sterilità e la Sessualità, Milano (Italy)
2IIRM, Lugano (Switzerland)
*Traduzione del testo pubblicato negli Atti, con aggiunta di minimi dettagli
INTRODUZIONE
L'Azoospermia Non-Ostruttiva (NOA) è oggi trattata mediante il recupero chirurgico di spermatozoi testicolari da usarsi per ICSI. L'Agoaspirato Testicolare (TeFNA e TESA), non correttamente tuttora in uso in molti Centri PMA, è oggi virtualmente ignorato dalle Linee-Guida della EAU (European Association for Urology), che riportano la TESE come la procedura raccomandata nelle NOA (Jungwirth, 2015). Negli ultimi anni la MicroTESE, ideata da Schlegel (1999), si è però accreditata come la tecnica più appropriata di recupero chirurgico nelle NOA, grazie al suo più elevato Tasso di Recupero di Spermatozoi (SRR). Raggiungere questo riconoscimento, oggi ampiamente condiviso in Letteratura, non è stato facile, anche perché la MicroTESE richiede, oltre al microscopio operatore e a strumenti chirurgici specifici, una esperienza microchirurgica certamente rara tra gli urologi. Comunque, oggigiorno il ricorso alla MicroTESE sta incrementandosi esponenzialmente: anche se non best place to buy viagra online forum di rado per ragioni di marketing sanitario, almeno a giudicare dai numerosi video reperibili su Internet, in cui molti dettagli tecnici di esecuzione microchirurgica da parte di alcuni autori dei video appaiono ben lontani dall'ottimale.
Confronto tra TESE e MicroTESE
Nelle NOA, la TESE può raggiungere un accettabile SRR in funzione del numero di prelievi bioptici dal testicolo (uno: 44,5%; due: 51,4%; tre: 56,1%; quattro: 58,4%)(Dadkhah, 2013): ma le incisioni sul testicolo, eseguite random ad occhio nudo, possono sezionare i vasi subalbuginei o lobulari, devascolarizzando alcuni lobuli testicolari ed aumentando il rischio di successivo ipogonadismo (Schlegel, 1997). La MicroTESE, ad occhi esperti in microchirurgia, permette la identificazione di isolati gruppuscoli di tubuli seminiferi più dilatati (Silber, 2000), quindi con probabile spermatogenesi residua, in tal modo massimizzando il recupero di spermatozoi, e consente la asportazione di singoli tubuli, permettendo al biologo di avere meno materiale, ma di migliore qualità, da sminuzzare e da esaminare alla ricerca di spermatozoi; in aggiunta, la migliore visualizzazione dei vasi testicolari, consentita dal microscopio operatore, permette una preservazione ottimale della irrorazione sanguigna del testicolo (Schlegel, 1999). Da una metanalisi su vari studi (Deruyver, 2013), il confronto tra MicroTESE e TESE evidenzia uno SRR più elevato della MicroTESE (42,9-63%) rispetto alla TESE (16,7-45%); ed una metanalisi ancora più ampia e recente di Bernie (2015) (su 1890 pazienti) ha di nuovo confermato che la MicroTESE ha un SRR 1,5 volte più elevato dello SRR della TESE (e che quest'ultimo è due volte più alto di quello dell'Agoaspirato Testicolare). La superiorità degli SRR della MicroTESE rispetto alla TESE è stata comprovata anche nei differenti quadri istopatologici testicolari delle NOA: 37% versus 14% nelle Sindromi a Sole Cellule di Sertoli (SCOS), 49% versus 27% negli Arresti Maturativi, 85% versus 73% nelle Ipospermatogenesi (Deruyver, 2013). Elevati SRR sono stati riportati, grazie alla MicroTESE, anche nei casi complicati di NOA: p.e. nelle NOA post-chemioterapia (48%), o da pregresso criptorchidismo (64%), o con microdelezione AZFc (67%)(Dabaja, 2013), o da Sindrome di Klinefelter (Sabbaghian, 2014); ed anche nei casi già precedentemente sottoposti a TESE con esito negativo (45-46,5%)[cosiddetta MicroTESE di salvataggio](Tsujimura, 2006; Ramasamy, 2007; Kalsi, 2014).
TECNICA CHIRURGICA ORIGINALE e nostri perfezionamenti
Sotto microscopio operatore, si esegue una incisione sul testicolo, in una area avascolare della tunica albuginea, lungo un piano equatoriale o para-equatoriale per 270° o più: la ghiandola viene poi durante l'intervento delicatamente e progressivamente aperta, evitando lo stretching del parenchima (apertura "a conchiglia"). Si procede ad una vasta esposizione dei tubuli seminiferi, seguendo la distribuzione dei vasi intratesticolari all'interno dei setti interlobulari (a 5-15x ingrandimento). E' indispensabile rispettare la vascolarizzazione dei lobuli testicolari ed evitare qualunque grossolano distacco della tunica albuginea (ricca di piccoli vasi facilmente sanguinanti) dal parenchima. Ad un ingrandimento di 15-24 x (e più raramente a 36 x, in caso di dubbio) si possono identificare eventuali tubuli più opachi e di calibro maggiore, che usualmente ospitano residui di spermatogenesi con gameti maturi. Mediante una accurata e delicata microdissezione dei lobuli esposti si accede ai loro tubuli seminiferi più profondi, approfondendosi, se necessario e dove opportuno, ad esplorare vari dei lobuli più interni. In molti testicoli di pazienti con NOA, i focolai di spermatogenesi residua hanno una distribuzione estremamente eterogenea: pertanto la microdissezione deve essere estremamente esplorativa. Nei casi più difficili, quando non si osservano tubuli più dilatati sulle superfici del parenchima del testicolo aperto "a libro", ci si insinua con le pinze di Vannas (con punte di 0,2 mm) in profondità lungo i setti, distaccando vari lobuli da quelli circostanti fin quasi a raggiungere la tunica albuginea opposta, "scandagliando" al massimo in tal modo il parenchima. I tubuli più dilatati, o quelli apparentemente più dilatati, sono asportati e passati al biologo (che deve essere) presente in sala operatoria per una ricerca immediata e meticolosa di eventuali spermatozoi. Alla fine, il tessuto testicolare è irrigato con soluzione di Ringer e antibiotico, e l'emostasi eseguita sostanzialmente mediante delicata pressione sul parenchima per 3-4 minuti con una garza intrisa di antibiotico ricorrendo, solo se strettamente necessario, al coagulatore bipolare con punta di 0,2 mm. L'albuginea viene ricostruita in sutura continua (VicrylTM 4-0 or 5-0), idealmente limitata alla metà esterna del suo spessore; si chiude poi la tunica vaginale, infondendo betametasone nella cavità vaginale al fine di prevenire aderenze e dolore post-operatorio; infine si suturano dartos e cute. Se l'atto chirurgico è stato eseguito meticolosamente, il decorso post-operatorio è virtualmente indolore, ed anche un attento controllo ecografico eseguito almeno tre mesi dopo molto difficilmente evidenzierà cicatrici interne al testicolo (Colpi, 2010).
RISULTATI
Il successo dipende estremamente dalla esperienza dell'andrologo microchirurgo, poichè la MicroTESE ha una curva di apprendimento estremamente lunga, con SRR soddisfacenti dopo i primi 100 casi trattati (Ishikawa, 2010); Schlegel sostiene che il SRR continua ad aumentare lentamente finchè non si è superata la soglia di 500 casi trattati, poichè solo allora gli occhi sono in grado di percepire al microscopio anche minime differenze di calibro dei tubuli (Dabaja, 2013). In un nostro recente studio prospettico in corso su 45 pazienti NOA, dove in totale abbiamo operato con MicroTESE 69 testicoli (il volume testicolare era 10-15 ml in 10 testicoli, 7-10 ml in 39, and < 7 ml in 20; l'esame istologico postoperatorio evidenziò Sindrome a Sole Cellule di Sertoli Completa in 50 testicoli, Sindrome a Sole Cellule di Sertoli Incompleta in 5, Arresto Maturativo in 11, Ipospermatogenesi in 2, Neoplasia Intratubulare [= Carcinoma in Situ] in 1) con un recupero positivo in 27 pazienti [cioè nel 60% degli operati], abbiamo classificato i tubuli seminiferi in "dilatati", "apparentemente dilatati" (a 24x ingrandimento), e "non-dilatati": abbiamo ottenuto un recupero positivo rispettivamente in 19 dei 21 testicoli con tubuli "dilatati", in 7 dei 19 testicoli con tubuli "apparentemente dilatati", and in 2 dei 29 testicoli con tubuli "non-dilatati". Abbiamo avuto un recupero positivo in 16 dei 50 testicoli con diagnosi istologica di Sindrome a Sole Cellule di Sertoli (> 32% di questi pazienti).
PUNTI DEBOLI e COMPLICAZIONI
La durata di un intervento di MicroTESE è molto più lunga di una TESE: 1,8 ore (range: 0,5-6,6 h) in caso di recupero positivo, e 2,7 ore (range 0,8-7,5 ore) in caso di recupero negativo (Ramasamy, 2011): pertanto è necessaria una anestesia generale e talvolta la permanenza in ospedale per una notte. Nella nostra serie di 740 MicroTESE operate finora, il tempo medio operatorio per una MicroTESE monolaterale con esito positivo è stato di 86,9 minuti (range: 60-140 minuti), e per una MicroTESE bilaterale (con recupero positivo o negativo) è stato di 125,8 minuti (range: 85-200 minuti). Paragonata alla TESE multipla, che è ritenuta molto più dannosa per il testicolo, per via delle possibili lesioni alla irrorazione testicolare (Schlegel, 1997) o per via dell'edema o di possibili ematomi intratesticolari (Silber, 2000), la MicroTESE è oggi considerata la procedura più sicura, con una minore incidenza di sanguinamenti (Schlegel, 1999; Okada, 2002) e di complicanze postoperatorie (quali ematomi, fibrosi parenchimale e riduzione postoperatoria del volume testicolare), come documentato dai controlli ecografici postoperatori (Amer, 2000; Okada, 2002; Ramasamy, 2005; Deruyver, 2013). Nelle nostre 740 MicroTESE, abbiamo avuto un solo ematoma (dovuto ad emostasi eseguita in stato di ipotensione del paziente non comunicataci dall'anestesista, e trattato subito dopo con esito positivo e con nessun danno parenchimale a distanza), nessun caso di infezione, nè di ipotrofia testicolare o di dolore a distanza, e ciò neppure nei casi in cui abbiamo eseguito due MicroTESE sullo stesso testicolo al fine di migliorare la esplorazione del parenchima. Inoltre, non viene documentata nessuna differenza rispetto alla TESE relativamente ad una eventuale ipotestosteronemia post-chirurgica (Okada, 2002; Ramasamy, 2005; Deruyver, 2013).
CONSIDERAZIONI DI RILIEVO SUI RECUPERI CHIRURGICI NELLE NOA
La MicroTESE sembra particolarmente indicata nei casi NOA più complicati o a prognosi teorica peggiore (Ashraf, 2013; Esteves, 2015), specialmente con FSH elevato (Ramasamy, 2009; Modarresi, 2015). L'utilità di un trattamento ormonale pre-operatorio è molto dibattuta. Vi sono alcune evidenze che una piccola parte di pazienti NOA possa ottenere un vantaggio dalla previa correzione chirurgica di un varicocele clinico, laddove presente (Colpi, 2005; Inci, 2009; Weedin, 2010). Nei pazienti NOA è stato descritto un aumentato rischio di CIS (Carcinoma in situ)(Jungwirth, 2015): pertanto in corso di intervento deve essere sempre prelevato un piccolo frammento bioptico che, appropriatamente fissato in liquido di Bouin, deve essere dato da leggere ad un patologo ben esperto (Dohle, 2012). Circa metà dei pazienti NOA sono già ipogonadici (cioè hanno un basso livello di testosterone) prima dell'intervento, e pertanto richiedono un controllo endocrino post-chirurgico, ed una eventuale (successiva !) terapia sostitutiva con testosterone, laddove necessaria (Bobjer, 2012). La ricerca biologica degli spermatozoi nei tubuli seminiferi asportati e frammentati deve essere eseguita da un biologo ben esperto in questo campo, che deve effettuarla all'interno della sala operatoria; è stato riportato un tasso di recupero positivo addizionale di +7% quando il materiale testicolare asportato viene esaminato da più biologi esperti e per alcune ore (Ramasamy, 2011). La gestione di questi campioni in Laboratorio richiede una speciale attenzione, poiché gli spermatozoi dei pazienti NOA sono più fragili e di qualità minore degli spermatozoi da liquido seminale (Esteves, 2015). Quando si repertano spermatozoi immobili da campioni testicolari, che siano a fresco o dopo congelamento-scongelamento, numerose differenti metodiche sono utilizzabili per differenziare gli spermatozoi vivi da quelli morti (HOS test, sperm tail flexibility test, e pentoxifylline stimulation) (Esteves, 2012). La vitrificazione sembrerebbe essere un metodo idoneo a crioconservare spermatozoi ottenuti da recuperi chirurgici positivi ma scarsi (Endo, 2012). La ICSI eseguita con spermatozoi freschi, o crioconservati e scongelati, appare ottenere risultati analoghi; mentre (ovviamente) i tassi di nati vivi da ICSI sono significativamente minori per i pazienti NOA (con azoospermia non-ostruttiva) (21.4% per embryo transfer^) rispetto a quelli OA (con azoospermia ostruttiva) (37.5% per embryo transfer)(He, 2010; Esteves, 2013).
Le recenti Canadian Guidelines affermano "Le procedure di recupero di spermatozoi testicolari dovrebbero essere proposte a tutti i soggetti con Azoospermia Non.Ostruttiva, ma dovrebbero essere eseguite solo in un Centro con esperienza in MicroTESE, e dove sia disponibile un Laboratorio ICSI con esperienza nella gestione di questi campioni" (Jarvi, 2015).
(^31,5% nella nostra serie più recente - N.d.R.)
Fig. 1: Talvolta tubuli dilatati possono essere identificati anche a ingrandimenti minori.
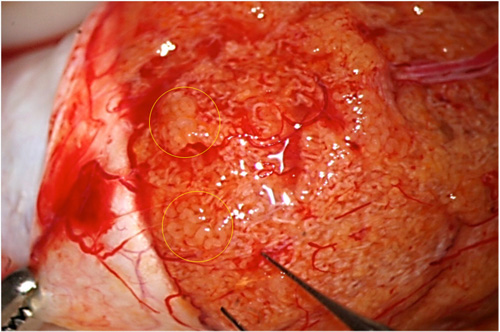
Fig. 2: Talvolta ingrandimenti maggiori consentono di meglio identificare tubuli dilatati.
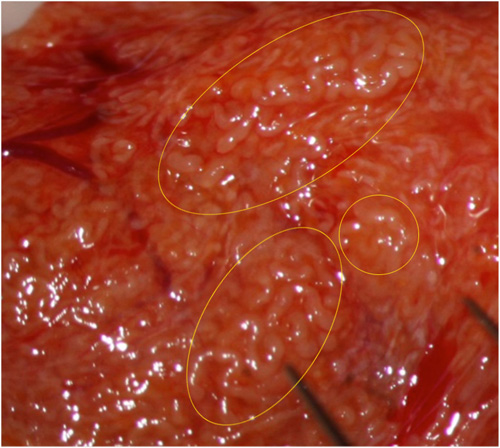
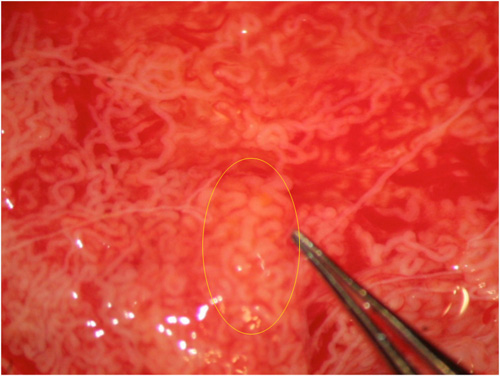
Fig. 3: Altre volte la dilatazione dei tubuli può essere identificata dolo a ingrandimenti elevate.
 REFERENCES
REFERENCES
Jungwirth A, Diemer T, Dohle GR, Giwercman A, Kopa Z, Krausz C, Tournaye H. Guidelines of Male Infertility. EAU Guidelines, 2014, p 9.
Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999; 14(1): 131-135.
Dadkhah F, Hosseini SJ, Sadighi Gilani MA, Farrahi F, Amini E, Kazeminejad B. Optimal number of biopsies and impact of testicular histology on the outcome of testicular sperm extraction. Urol J 2013; 10: 795-801.
Schlegel PN, Su LM. Physiological consequences of testicular sperm extraction. Hum Reprod 1997; 12: 1688-1692.
Silber SJ. Microsurgical TESE and the distribution of spermatogenesis in non‑obstructive azoospermia. Hum Reprod 2000; 15: 2278-2284.
Deruyver Y, Vanderschueren D, Van der Aa F. Outcome of microdissection TESE compared with conventional TESE in non‑obstructive azoospermia: a systematic review. Andrology 2014; 2: 20-24.
Bernie AM, Mata DA, Ramasamy R, Schlegel PN. Comparison of microdissection testicular sperm extraction, conventional testicular sperm extraction, and testicular sperm aspiration for nonobstructive azoospermia: a systematic review and meta-analysis. Fertil Steril 2015; 104:1099-1103.
Dabaja AA, Schlegel PN. Microdissection testicular sperm extraction: an update. Asian J Androl 2012; 15: 35-39.
Sabbaghian M, Modarresi T, Hosseinifar H, Hosseini J, Farrahi F, Dadkhah F, Chehrazi M, Khalili G, Sadighi Gilani MA. Comparison of sperm retrieval and intracytoplasmic sperm injection outcome in patients with and without Klinefelter syndrome. Urology 2014; 83:107-110.
Tsujimura A, Miyagawa Y, Takao T, Takada S, Koga M, Takeyama M, Matsumiya K, Fujioka H, Okuyama A. Salvage microdissection testicular sperm extraction after failed conventional testicular sperm extraction in patients with nonobstructive azoospermia. J Urol 2006; 175:1446-9; discussion 1449.
Ramasamy R1, Schlegel PN. Microdissection testicular sperm extraction: effect of prior biopsy on success of sperm retrieval. J Urol 2007;177:1447-1449.
Kalsi JS1, Shah P, Thum Y, Muneer A, Ralph DJ, Minhas S. Salvage micro-dissection testicular sperm extraction; outcome in men with non-obstructive azoospermia with previous failed sperm retrievals. BJU Int 2015; 116: 460-465.
Colpi GM, Piediferro G, Scroppo FI, Colpi EM, Sulpizio P: Surgery for male infertility: Surgical sperm retrievals. In Bjorndahl L, Giwercman A, Tournaye H, and Weidner W (eds), Clinical Andrology, London, Informa Healthcare, pp 95-104.
Ishikawa T, Nose R, Yamaguchi K, Chiba K, Fujisawa M. Learning curves of microdissection testicular sperm extraction for nonobstructive azoospermia. Fertil Steril. 2010; 94: 1008-1011.
Ramasamy R, Fisher ES, Ricci JA, Leung RA, Schlegel PN. Duration of microdissection testicular sperm extraction procedures: relationship to sperm retrieval success. J Urol. 2011; 185: 1394-1397.
Okada H, Dobashi M, Yamazaki T, Hara I, Fujisawa M, Arakawa S, Kamidono S. Conventional versus microdissection testicular sperm extraction for nonobstructive azoospermia. J Urol. 2002; 168: 1063-1067.
Amer M, Ateyah A, Hany R, Zohdy W. Prospective comparative study between microsurgical and conventional testicular sperm extraction in non-obstructive azoospermia: follow-up by serial ultrasound examinations. Hum Reprod 2000; 15: 653-656.
Ramasamy R, Yagan N, Schlegel PN. Structural and functional changes to the testis after conventional versus microdissection testicular sperm extraction. Urology 2005; 65: 1190-1194.
Ashraf MC, Singh S, Raj D, Ramakrishnan S, Esteves SC. Micro‑dissection testicular sperm extraction as an alternative for sperm acquisition in the most difficult cases of azoospermia: technique and preliminary results in India. J Hum Reprod Sci 2013; 6: 111-123.
Esteves SC. Clinical management of infertile men with nonobstructive azoospermia. Asian J Androl 2015; 17: 459-470.
Ramasamy R, Lin K, Gosden LV, Rosenwaks Z, Palermo GD, Schlegel PN. High serum FSH levels in men with nonobstructive azoospermia does not affect success of microdissection testicular sperm extraction. Fertil Steril 2009; 92: 590-593.
Modarresi T, Hosseinifar H, Daliri Hampa A, Chehrazi M, Hosseini J, Farrahi F, Dadkhah F, Sabbaghian M, Sadighi Gilani MA. Predictive factors of successful microdissection testicular sperm extraction in patients with presumed Sertoli cell-only syndrome. Int J Fertil Steril 2015; 9: 107-112.
Colpi GM, Piediferro G, Nerva F, Giacchetta D, Colpi EM, Piatti E. Sperm retrieval for intra-cytoplasmic sperm injection in non-obstructive azoospermia. Minerva Urol Nefrol 2005; 57: 99-107.
Inci K, Hascicek M, Kara O, Dikmen AV, Gürgan T, Ergen A. Sperm retrieval and intracytoplasmic sperm injection in men with nonobstructive azoospermia, and treated and untreated varicocele. J Urol 2009; 182: 1500-1505.
Weedin JW, Khera M, Lipshultz LI. Varicocele repair in patients with nonobstructive azoospermia: a meta‑analysis. J Urol 2010; 183: 2309-2015.
Dohle GR, Elzanaty S, van Casteren NJ. Testicular biopsy: clinical practice and interpretation. Asian J Androl 2012; 14: 88-93.
Bobjer J, Naumovska M, Giwercman YL, Giwercman A. High prevalence of androgen deficiency and abnormal lipid profile in infertile men with non-obstructive azoospermia. Int J Androl 2012; 35: 688-694.
Ramasamy R, Reifsnyder JE, Bryson C, Zaninovic N, Liotta D, Cook CA, Hariprashad J, Weiss D, Neri Q, Palermo GD, Schlegel PN. Role of tissue digestion and extensive sperm search after microdissection testicular sperm extraction. Fertil Steril 2011; 96: 299-302.
Esteves SC, Varghese AC. Laboratory handling of epididymal and testicular spermatozoa: what can be done to improve sperm injections outcome. J Hum Reprod Sci 2012; 5: 233-43.
Endo Y, Fujii Y, Shintani K, Seo M, Motoyama H, Funahashi H. Simple vitrification for small numbers of human spermatozoa. Reprod Biomed Online 2012; 24: 301-307.
He X, Cao Y, Zhang Z, Zhao J, Wei Z, Zhou P, Cong L. Spermatogenesis affects the outcome of ICSI for azoospermic patients rather than sperm retrieval method. Syst Biol Reprod Med 2010; 56: 457-464.
Esteves SC, Agarwal A. Reproductive outcomes, including neonatal data, following sperm injection in men with obstructive and nonobstructive azoospermia: case series and systematic review. Clinics (Sao Paulo) 2013; 68 Suppl 1: 141-150.
Jarvi K, Lo K, Grober E, Mak V, Fischer A, Grantmyre J, Zini A, Chan P, Patry G, Chow V, Domes T. CUA Guideline: The workup and management of azoospermic males. Can Urol Assoc J 2015; 9:229-235.
